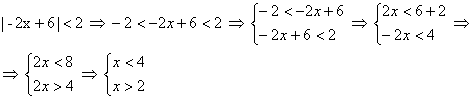Oi pequenos duendes do mal! Amanhã tem prova de Química e vocês precisam estudar! =x
Seguem algumas respostas da lista de termoquímica do 2º ano (Madalena) :)
1)
a) exotérmico
b) endotérmico
c) exotérmico
d) exotérmico
e) endotérmico
f) exotérmico
g) exotérmico
h) exotérmico
i) exotérmico
j) endotérmico
2)
a) Verdadeiro (Percebam que o calor vem somado no lado dos reagentes, logo a reação é endotérmica)
b) Verdadeiro (Se a reação é endotérmica, logo o (delta)H é positivo, significando que na conta:
(delta)H = Hp - Hr, o Hp é maior que o Hr
c) Verdadeiro (ver a explicação na letra b)
d) Falso (Observe a reação, veja que são necessários 3 mols de carbono (36 gramas = 3 . 12g) para um mol de óxido metálico (Fe2O3) transformado, logo o quesito é verdadeiro)
e) Verdadeiro (Observe a reação e veja a seguinte regra de três, pequenino ;D:
3 mols de carbono - absorvem 492 kJ
1 mol de carbono - absorve x
Faça a conta, pequeno duende, não demora! Isso dará o resultado de 164 kJ) ;D
3)
O processo que absorve mais calor é o terceiro, depois eu desenho o gráfico e posto aqui ;D. Percebam que há mudança de estado de gasoso para líquido.
4)
Pois bem, essa questão será feita com a resolução de várias regras de 3, duendes...
Vamos lá!
O ciclista pedala 6 horas e gasta 8,01 kcal/min. Então temos:
8,01 kcal - 1minuto
x kcal - 360 minutos (6 horas)
x = 2883,6 kcal
Pela reação sabemos que um mol de sacarose (C12H22O11) libera 1350 kcal/mol, então temos que descobrir a quantidade, em mol, de sacarose que precisaremos para liberar 2883,6 kcal!
1 mol de sacarose - 1350 kcal
x mol de sacarose - 2883,6 kcal
Logo, temos que x = 2,1 mol de sacarose = 2,1 . 342g = 718,2 g de sacarose
Obs.: 342g é a massa da sacarose, na questão ele pede a quantidade em gramas e não em mol, então usa-se a fórmula do mol: n = m/MM :)
7) Se a queima do carbono é uma reação exotérmica, temos que o (delta)H é negativo, logo, na conta:
(delta)H = Hp - Hr, o Hr é maior que o Hp, então temos a reação de queima do carbono:
C + O2 -:> CO2
A soma dos reagentes é maior que os produtos, logo a resposta é a letra C.
Depois eu posto mais, porque preciso ir! Adeus! :*